免疫治疗在近三十年蓬勃发展,并取得了众多成果。
发现肿瘤细胞表面抗原,打通肿瘤免疫逃逸机制,探索细胞因子和抗体,为免疫治疗提供了新的靶点和手段。
CAR-T细胞疗法和PD-1抑制剂等新型免疫治疗方法问世,为癌症治疗带来了革命性的突破。
CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy嵌合抗原受体T细胞免疫疗法)在白血病、淋巴瘤、多发性骨髓瘤等疾病治疗中展现出的惊艳效果,使其成为目前全球肿瘤免疫治疗领域中最为火热的研究领域。
但是在实体肿瘤的治疗上,CAR-T的表现始终不够理想。
首先,CAR结构设计对于CAR-T细胞在体内的激活非常关键,在实体瘤中对CAR结构的设计要求更高,这是对团队在技术和经验上的双重考验。在技术原理上,实体瘤的空间结构对CAR-T细胞浸润有一定阻碍作用,使得实体瘤内部无法接触到CAR-T细胞,且内部还存在对CAR-T细胞有抑制作用的细胞和分子,肿瘤细胞依旧在疯狂生长。另一方面,在杀伤实体瘤时,CAR-T细胞耗竭严重,在体内的扩增能力将大大降低,治疗效果也就大打折扣。
01
“重启”免疫系统,分化抗肿瘤T细胞
针对免疫治疗的现状,我们应该怎样来提高免疫治疗的效果?
迄今为止,被广泛应用的一些免疫疗法主要是通过外力来实现免疫功能的改善,并没有实现通过对内部免疫系统的改造,进而实现免疫功能的自主且长期的转变。如果能够“重启”体内免疫细胞的功能,使机体自发地抵御肿瘤细胞的侵蚀,或可为目前最理想的免疫疗法思路。
将“筋疲力尽”或已经免疫逃逸的现有免疫细胞(主要针对T细胞)进行彻底清除,迫使人体免疫系统能够产生不携带免疫记忆的全新T细胞,完成免疫功能的“重启”。该类T细胞将分化成抗肿瘤能力更强的T细胞,逆转免疫系统耗竭,使人体恢复到一个健康的状态。
根据这一开发思路,CAMPATH®(抗CD52单抗)、Thymoglobuline®(兔抗腺细胞球蛋白)T Guard(ADC药物)等“先行者”已经进行了相关探索。
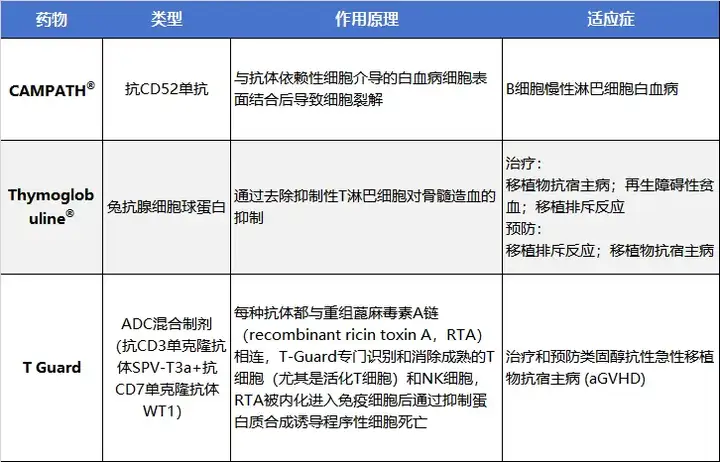
图1 免疫重启疗法相关药物介绍
数据来源:药智数据,药智咨询整理
2001年5月7日,美国初次批准CAMPATH®上市,后又在欧洲、加拿大、日本、韩国、中国台湾、中国香港等国家和地区上市,被批准作为B细胞慢性淋巴细胞白血病(B-CLL)的注射治疗药物。2008年8月27日,赛诺菲安万特研发的Thymoglobuline®获批上市,目前已批准用于移植物抗宿主病、再生障碍性贫血、移植排斥反应的相关治疗,以及预防移植排斥反应和移植物抗宿主病。根据药智数据库统计,2023年Thymoglobuline®在中国地区共销售25.99万剂,销售额近6.2亿元人民币。T-Guard是Xenikos自Henogen处引进的一款ADC混合制剂,在2023年3月因安全性问题被迫终止在GvHD的III期临床研究。
虽然上述药物均能够发挥清除T细胞的功能,但清除方式均不具有特异性,且CAMPATH®和Thymoglobuline®清除效果不完全,T-Guard更是存在安全性问题。
02
多项适应症齐开临床试验,VG712或为最理想免疫疗法
由此可见,重启免疫细胞的功能并非简单地杀死T细胞就能够实现,真正“重启”细胞免疫功能的药物应该具备特异性高、亲和力强、清除彻底、作用短暂且安全性高等特点。
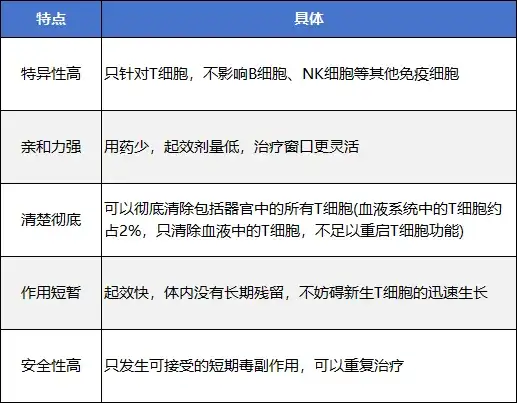
图2 免疫细胞功能重启药物的条件
数据来源:药智数据,药智咨询整理
1994年,David Neville博士、HUAIZHONG HU(胡怀忠)博士开始针对CD3靶点的双价毒素蛋白分子构建和机理进行验证,打通并简化相关生产工艺,开创了免疫毒素领域的研究先河。2008年,David Neville博士、Yuan-Yi Liu博士和Jung-Hee Woo博士联合创立了Angimmune公司,团队联合哈佛大学、路易斯维尔大学将该项研究推进到适应症及安全性探索阶段,相继完成了有关器官移植、皮肤T细胞淋巴瘤、PD-1实体瘤联合疗法等方向的临床前/临床I期研究,并申请了相关发明专利。
2014年取得FDA孤儿药资格认定,2016年因其临床显著疗效取得FDA快速审评资格。2023年2月,NIH批准成都维瑾柏鳌生物医药科技有限公司(以下简称:维瑾生物)下属美国子公司、香港子公司获得该管线的全球独家商业开发权,现管线名为VG712。
VG712是一种针对T细胞CD3位点的抗体结合域片段,与经过改造的白喉毒素进行融合的二价融合蛋白,可以通过与T细胞特异性结合后进行内吞,在胞内释放毒素杀死T细胞。发展至今,VG712已成为目前最有希望实现免疫细胞功能重启的药物。
相关现有研究表示,VG712可在短时间内彻底清除人体内的T细胞,从而促使细胞免疫系统进行重启,产生大量新T细胞,从此恢复正常的免疫功能。该方法能够提高T细胞长期识别和攻击肿瘤细胞的能力;诱导器官移植后的免疫耐受,提高器官的功能和生存期;特异性清除淋巴系统中的T细胞,最大程度地提高CAR-T疗法的治疗效果和安全性,改善癌症患者的结果;降低T细胞对自身器官的攻击,改善T细胞介导的自身免疫性疾病的进展;以及清除艾滋病患者体内的T细胞潜伏病毒库,逆转耐药病人的病情等。
根据公开临床研究结果,美国开展的CTCL临床I期研究已经证实VG712能在4天内快速有效清除病人体内T细胞,14天内T细胞恢复至治疗前水平,且专门抗肿瘤的CD8记忆性T细胞比治疗前增长20倍。并且,多例晚期的皮肤T细胞淋巴瘤病人已经实现临床治愈,让VG712在机理和疗效上获得了双重认可。动物试验表明,VG712与已经上市的T细胞清除药物相比,不仅可以有效清除循环系统里面的T细胞,还可以有效清除器官里面的T细胞。
根据维瑾生物对VG712的发展规划,2024年将开展皮肤T细胞淋巴瘤(CTCL)在美国的确证性临床研究,同时,也将准备启动肾器官移植后免疫耐受诱导的I期临床研究、激素耐药后GvHD的I期临床研究、CAR-T治疗前的清淋处理的I期临床研究。在艾滋病、自身免疫疾病等领域的研究也正在寻找合作伙伴共同推进。
03
销售额预计超700亿美金,免疫治疗迎来新希望
VG712带来细胞免疫功能重启的新希望,开拓了免疫治疗领域的新方向,将在抗肿瘤、诱导免疫耐受、器官移植、CAR-T治疗前的清淋处理等方面取得重大突破。
据药智咨询评估,目前进展最快的适应症CTCL有望在上市后5年(2029年-2033年)在全球市场(美国、欧洲、中国、东南亚市场)累积实现5.39亿美元的销售。销售额预计在2038年达峰,年销售峰值2.68亿美元,上市10年(2029年-2038年)可在全球市场累积创造16.79亿美元的销售。
综合现有临床适应症,根据rNPV估值法,VG712在计划上市十年内(2028年-2038年)全球市场销售额约为739.33亿美元。在CAR-T治疗前的清淋处理、器官移植后免疫耐受诱导、激素耐药后GvHD、自身免疫性疾病、艾滋病等领域,临床需求明显,且现有上市产品痛点较多,结合VG712创新的治疗原理和优秀的临床表现,该管线均有望在上市当年便实现超过3亿美元的市场销售额。
一种真正自主、长期发挥作用的免疫疗法,VG712或将开辟肿瘤治疗的第三条路线,成为免疫治疗领域未来二三十年中必不可少的药物。
前有“司美格鲁肽”这样的千亿级大单品,VG712是否会是下一个?
请您联系QQ(992 5835),本网站将在收到信息核实后24小时内删除相关内容。
- 重大突破!新一代免疫疗法或将迎来下一个千亿大单品吗?(2024-04-26)
- BOE(京东方)携手中关村论坛 共筑全球科技创新新高地(2024-04-26)
- 陕西潼关:知识产权保护激活产业发展“新动能”(2024-04-26)
- 万妮达浪姐5以可爱实力出圈,艾力艾面包鞋应援潮流反差萌(2024-04-25)
- 深圳希玛林顺潮眼科医院:躺着玩手机经常手滑?小心导致视网膜脱离......(2024-04-25)
- 重大突破!新一代免疫疗法或将迎来下一个千亿大单品吗?(2024-04-26)
- BOE(京东方)携手中关村论坛 共筑全球科技创新新高地(2024-04-26)
- 陕西潼关:知识产权保护激活产业发展“新动能”(2024-04-26)
- 万妮达浪姐5以可爱实力出圈,艾力艾面包鞋应援潮流反差萌(2024-04-25)
- 深圳希玛林顺潮眼科医院:躺着玩手机经常手滑?小心导致视网膜脱离......(2024-04-25)
- DingPay钱包——面向多链未来的WEB3 钱包(2024-04-25)
- 伟帮服饰——时尚定制 “衣”路风采(2024-04-25)
- 巨星传奇拟配售3152.2万股净筹约2.23亿港元 市场反应正面(2024-04-24)
- OPPO K12正式发布,开启百瓦闪充超长续航双普及时代(2024-04-24)
- 读书人硬控阅读!种什么样的种子,就开什么样的花(2024-04-24)
- 微讲师智能讲台亮相第83届中国教装展,新一代多媒体教室引瞩目!(2024-04-24)
- 2024年冰峰大会暨青年科学探索活动在川开启,瑞士艾米龙再赴“冰川之约”(2024-04-24)
- 为民族品牌赋能为实体经济助力 新消费新零售促进经济大循环(2024-04-24)
- 完美胡瑞连:集智聚力健康中国 共谋未来新发展(2024-04-24)
- 完美公司:高品质服务赢得消费者信赖(2024-04-24)
- 淘宝百亿秒杀节补贴又加码?至高补贴3000元!(2024-04-24)
- 引领家电新风尚!品霸王智能家电官宣体育冠军程晨为品牌代言人(2024-04-24)
- 杭州大象传媒是如何把短视频矩阵获客做到极致(2024-04-24)
- 日化智云带你探索内衣洗护市场爆款养成之路(2024-04-24)
- 水果店怎么才能开好?从高人气品牌吉小果了解水果加盟(2024-04-24)
- 点石成精举办特别美势破圈连锁高峰论坛(2024-04-24)
- 用一个单品打造一家连锁——点石成精第五季定位魔法轮精彩回顾(2024-04-24)
- “苹”水相逢 共赴“疆”来|“杭州-阿克苏同心杯”2024阿克苏市马拉松成功举办(2024-04-23)
- 郎酒深化产学研合作,寻求酿酒专用小麦科研新突破(2024-04-23)
- 潮汕商会携手深圳中和堂推出英歌舞巡演活动圆满成功(2024-04-23)
- 世界读书日:北京链家化身“家门口的公益捐赠入口”(2024-04-23)
- 双极水献爱心,春雨沐体温暖夕阳 —— 湿洗助浴项目走进养老机构(2024-04-23)
- 筑牢居住安全“防火墙”恭喜“文盛昊”装饰材料品牌荣获央视品牌展播(2024-04-23)
- 保费不变,保障再升级!2024版“沪惠保”正式上线 进一步拓宽受益人群、保障范围(2024-04-23)
- OPPO K12搭载超抗摔金刚石架构,十面耐摔耐弯折(2024-04-23)
热点排行
- 1 还未登场先获好评,长安凯程全新重磅产品究竟强在哪?
- 2 屯留区“屯味长留”区域公用品牌盛大发布,共绘乡村振兴新篇章
- 3 万纬物流发布首份《环境、社会及管治报告》
- 4 中国工业科技创新专业委员会在京成立 国潮机甲计划正式启动
- 5 钟杰:“茅香郎味”是记忆茅台和青花郎的实用性方法
- 6 格罗优,传统“吃铁补铁”方式的破局者 为什么要补铁?
- 7 功效护肤平价时代来临:逸仙电商转型成功,洗脸吧等新兴赛道崛起展现广阔前景
- 8 OPPO K12将于4月24日发布,普及百瓦闪充长续航
- 9 中西文化交相辉映 AI演绎“瑶族舞曲” 香港浸会大学交响乐团举办周年音乐会
- 10 世界地球日|响应“全球战塑”号召,引领绿色睡眠新风尚





